Um novo estudo na Nature-Cancer preveniu com sucesso o crescimento de neuroblastoma em camundongos, modificando as células CAR-T. Isso significa que as células CAR-T, que geralmente têm um bom efeito apenas em tumores hematológicos, também podem desempenhar um papel em tumores sólidos.
Isso não significa apenas que o neuroblastoma pode ser tratado com CAR-T, e se as idéias do estudo forem seguidas, talvez o confinamento de CAR-T em tumores sólidos seja finalmente quebrado.
Precisamos saber que o receptor de antígeno quimérico mais básico é geralmente formado pela fusão do domínio de ligação ao antígeno tumoral extracelular e a cadeia CD3-ζ intracelular. O primeiro pode ajudar as células T a direcionar os tumores, e o último pode fornecer sinais de iniciação imunológica.
Então, há duas maneiras de aprimorar a função do CAR-T. Uma é aumentar a área de reconhecimento do antígeno extracelular para aumentar a capacidade de caçar tumores; a outra é aumentar os sinais internos para manter o crescimento e o metabolismo das células T. Deixe-o existir no corpo por mais tempo.
O primeiro é mais fácil de entender, porque geralmente há uma variedade de antígenos na superfície das células tumorais, e as células CAR-T geralmente podem reconhecer alguns desses antígenos após a modificação para atacar o alvo. Precisamos apenas adicionar alvos externos que ataquem diferentes antígenos ao mesmo tempo para melhorar a capacidade anticâncer do CAR-T. Este é também o conceito CAR-T de duplo direcionamento que está surgindo recentemente.
Em comparação com as células CAR-T que reconhecem apenas um antígeno, essas células T de alvo duplo podem rastrear o paradeiro das células cancerosas com mais eficiência e impedi-las de escapar do sistema imunológico.
Para modificação interna, nas últimas gerações de iterações de atualização da tecnologia CAR, os receptores de antígenos quiméricos basicamente adicionaram algumas moléculas coestimulatórias, incluindo CD28 e 4-1BB, etc., as moléculas coestimulatórias podem manter e aumentar a função e capacidade de proliferação de CAR-T.
No entanto, estudos anteriores usando uma única molécula coestimuladora em receptores quiméricos de alvo duplo descobriram que isso não pode controlar o crescimento do tumor por um longo tempo, nem pode resolver o problema de tumores sólidos. Portanto, a equipe de pesquisa da Universidade da Carolina do Norte decidiu introduzir os sinais de duas moléculas coestimulatórias ao mesmo tempo e carregá-los em diferentes receptores de alvo duplo para promover ainda mais a capacidade das células CAR-T.
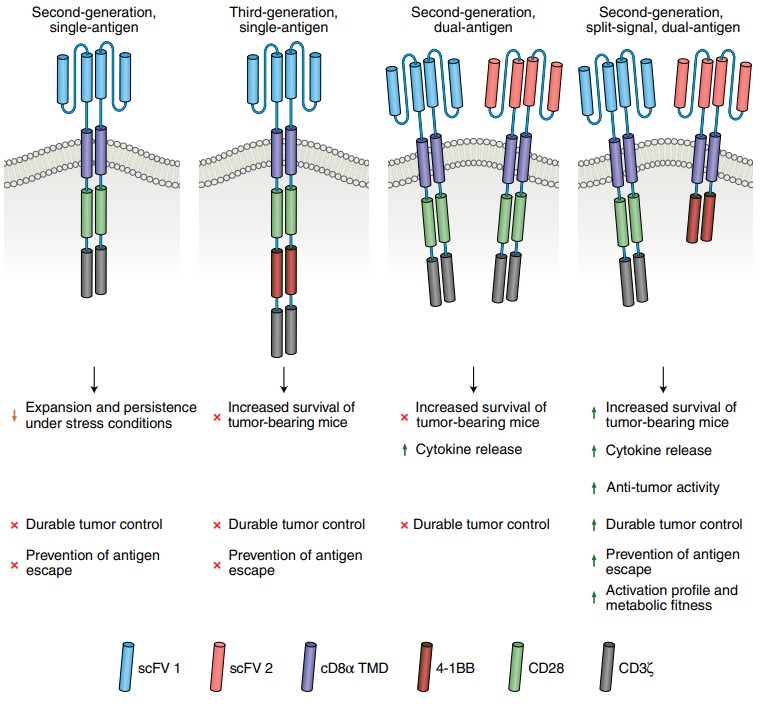
O estudo usou neuroblastoma como o alvo do teste, e as células CAR-T também carregam as regiões de ligação alvo dos antígenos tumorais GD2 e B7-H3, e os dois receptores quiméricos carregam, cada um, uma molécula coestimuladora CD28 ou 4-1BB. Este CAR-T de duplo alvo-duplo sinal pode matar completamente as células in vitro após serem co-cultivadas com neuroblastoma.
No experimento com camundongos, os pesquisadores introduziram células de neuroblastoma em camundongos, e os camundongos usando apenas um único antígeno alvo sofreriam recorrência do tumor logo em seguida. No entanto, as gerações anteriores de métodos CAR-T não podem prevenir o processo de recorrência do tumor. Apenas células CAR-T de duplo sinal-alvo duplo podem atingir esse objetivo e controlar o crescimento do tumor.
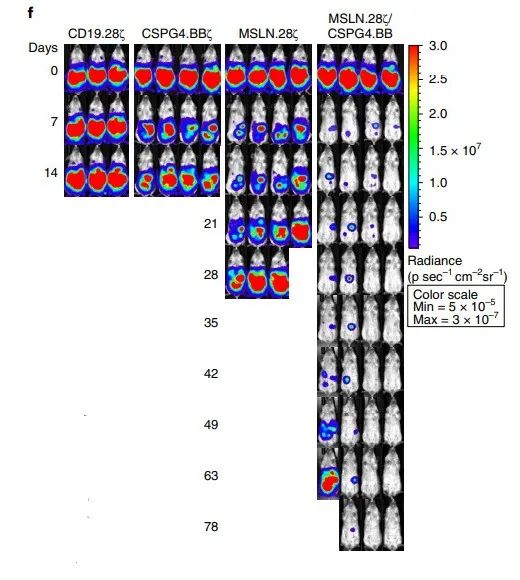
E os camundongos que recebem a nova terapia ainda podem alcançar o efeito de controle do tumor, mesmo que sejam submetidos ao processo de reestimulação do tumor. Os resultados do teste mostram que após 2 e 4 semanas de tratamento, altos níveis de células CAR-T de duplo-alvo-duplo sinal ainda podem ser detectados nos camundongos. Isso significa que essas células podem durar para sempre no corpo.
Pelos resultados dos testes, essa vantagem pode advir da assistência mútua dos dois sinais na célula. Por exemplo, o receptor quimérico de CD28 e 4-1BB pode melhorar o efeito do sinal de CD3-ζ e aumentar o metabolismo e a proliferação de células T.
Em geral, o estudo fornece uma nova ideia de usar o CAR-T para resolver tumores sólidos. No entanto, as moléculas coestimulatórias específicas a serem utilizadas precisam ser determinadas de acordo com diferentes ambientes de tumor.